Telomer nedir? Telomer eksilmesini durdurarak yaşlanmayı yenebilir miyiz?
Telomeraz, her bir döngüde yeni üretilen DNA'nın ucuyla hibritleşen RNA alt birimini baz alarak DNA'yı biraz daha uzatır ve işlem sonunda bir birim ileri kayarak aynı işlemi tekrar başlatır.

Yaşlanmak, her canlı için hayatın bir parçasıdır. Yaşlanmanın pek çok sebebi vardır. Bu sebepler arasında programlanmış hücre ölümü, DNA hasarları ve toksinlerin etkisi sonucu oluşabilecek kanserleri sayabiliriz. Ayrıca yaşlanmanın en büyük nedenlerinden biri de telomer eksilmesidir.
Telomerler her bir kromozomun iki ucunda da bulunan spesifik DNA-protein yapılarıdır. Telomerler, tekrarlanan kısa DNA dizilerinden oluşmaktadır.
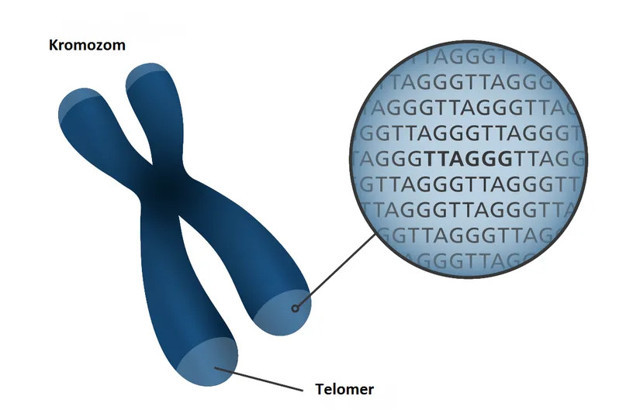
TELOMERLER NEDEN EKSİLİYOR?
DNA replikasyonu sonucunda DNA kendisine eş yeni bir DNA üretir. DNA’nın 3’ ve 5’ olmak üzere iki ucu bulunmaktadır. Hücre bölüneceği zaman 3’ ucunun karşısına 5’ ucu, 5’ ucunun karşısına ise 3’ ucunun gelmesi gerekmektedir. DNA replikasyonunda yer alan DNA polimeraz enzimi sadece 3’ hidroksil grubuna bir dNTP (DNA nükleotid bazları) ekleyerek, DNA’yı 5’ ucundan 3’ ucu yönünde sentezlemeye başlar, ancak DNA polimeraz enzimi, 5’ grubundan yeni bir dNTP sentezine başlayamaz. Burada devreye RNA polimeraz girmektedir. RNA polimeraz, 5’ ucundan sentezi başlatır ve sentezlediği primer ipliğe DNA polimeraz dNTP ekleyebilir. DNA polimerazın bu özelliği, hücre üremesi için gerekli olan DNA replikasyonundaki yüksek doğruluğunun korunması için oldukça önemlidir.
DNA replikasyonu bittiği zaman, RNA polimerazın ürettiği primer ipliğin ortadan kaldırılması gerekmektedir. Yoksa yeni sentezlenen DNA da normalde bulunmayan urasil gibi nükleotidler bulunur. Bunun sonucu olarak da her DNA replikasyonu sonrasında kromozom boyu kısalır, çünkü DNA polimeraz ana zincirde 3’ ucunda (primerin çıkarıldığı uçta) yeni bir DNA sentezi başlatamaz.
Sonuç olarak kromozomların uç dizilerin replikasyonu için özel mekanizmalara ihtiyaç vardır. Telomerler burada devreye girmektedir. Telomerler, sentezlerini DNA kalıbı olmaksızın katalizleyerek telomerleri koruyan, telomeraz olarak isimlendirilen bir enzim sayesinde replike olmaktadırlar.
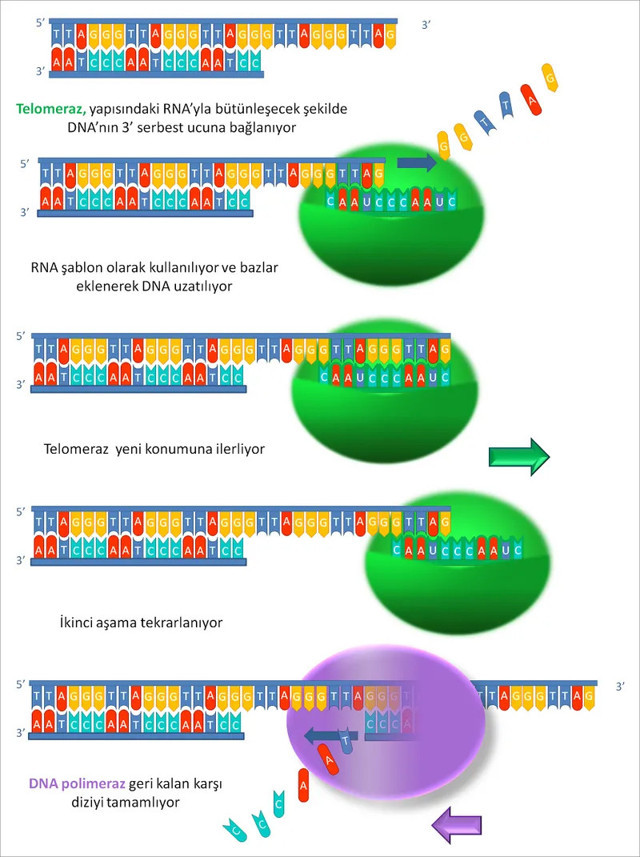
Telomeraz enzimi bu uç kromozom problemini, telomerik tekrar dizilerini kromozomun 3’ ucuna takarak önlemektedir.
Telomeraz, her bir döngüde yeni üretilen DNA'nın ucuyla hibritleşen RNA alt birimini baz alarak DNA'yı biraz daha uzatır ve işlem sonunda bir birim ileri kayarak aynı işlemi tekrar başlatır.
Bölünen hücrelerde telomerlerin normal uzunluklarının korunması telomeraz aktivitesi ile düzenlenir. Ancak telomeraz enzimi somatik hücrelerde az miktarda bulunmaktadır. Bunun nedeni telomeraz enzimini ifade eden (eksprese eden, üreten) DNA dizisinin baskılanmış olmasıdır. Hücrede telomeraz seviyesi bittiği zaman, her hücre bölünmesinde telomer boyu yaklaşık 100 baz çifti kadar azalmaktadır. Bu durum devam ettikçe, hücrenin DNA dizisinde bozulmalar meydana gelecek ve hücrenin bölünmesi duracaktır. Hücre bölünemediği zaman artan yüzey-hacim oranına, artan büyüklüğüne karşı herhangi bir cevap veremez ve bunun sonucu olarak da hücre ölümü meydana gelir. Hücre, yeni hücreler oluşturamadan öldüğü için, organizmanın genelinde yaşlanma meydana gelecektir. Sınırsız bölünme yeteneğine sahip kanser hücreleri ise telomerlerini koruma yeteneğine sahip hücrelerdir. Kanser tedavisinde telomerazın ortadan kaldırılmasıyla tedavi edilebileceği öne sürülmüştür; ancak bununla ilgili kesin bir bulguya henüz ulaşılamamıştır.
Somatik hücrelerde telomer kaybı ile yaşlılık arasında bir ilişki söz konusudur. Örneğin; Progeria'da (Hızlı Yaşlanma Hastalığı) ciddi bir telomer kısalması ve kaybı görülmektedir. Ayrıca bazı insan deri kanserlerinde (melanoma), telomeraz aktivitesindeki artış ile sonuçlanan mutasyonların, artan telomeraz seviyesinin kanser gelişimine doğrudan katkı sağlayabileceğini desteklemektedir.
TELOMERAZ, ÖLÜMÜ DURDURABİLİR Mİ?
Peki o zaman neden hücrelere telomeraz takviyesi yapıp insan ömrü uzatmıyoruz? Çünkü bizde somatik hücre sayısı oldukça fazla ve vücudumuzun çok çeşitli yerlerine dağılmış durumda. Burada yapılabilecek bir gen tedavisi çalışması ile somatik hücrelerimize ''telomeraz'' enzimini kodlayabilecek bir gen dizilimine sahip bir vektör yerleştirmek gerekmektedir. Yerleştirilecek bu vektörün aynı zamanda hiçbir hücrede toksititeye neden olmaması ve uzun süre ekspresyon yapabilme kabiliyetinde olması gerekmektedir. Böyle bir tedavi yöntemini bulmak oldukça güç, maliyetli ve oldukça iyi bir laboratuvar gerektirmektedir.
Ayrıca hücrede oluşacak telomeraz seviyesini de belirlemek güç olacaktır. Telomeraz enzimi her ne kadar kromozom boyunun küçülmesini engellese de yüksek telomeraz seviyesi kansere ve tümöre neden olmaktadır.
Büyük bir diğer sorun da, telomeraz ile yaşlanmanın (ve ölümün) ilişkisinin henüz halen tam olarak ispatlanamamış olmasıdır. Örneğin 2009 yılındaki Nobel Fizyoloji-Tıp Ödülü, ''kromozomdaki telomerler ve telomeraz enzimi tarafından nasıl korunduklarının keşfinden dolayı'' Elizabeth H. Blackburn, Carol W. Greider ve Jack W. Szostak'a verilmiştir. Bu üçlüden Elizabeth Blackburn, telomerler ile yaşlanma arasında bir korelasyon olmasının, ikili arasında bir neden-sonuç ilişkisi anlamına gelmiyor olabileceğine dikkat çekmektedir. Hatta yapılan çalışmalar, telomeraz eksikliği gibi, fazlalılığının da hücre içerisinde sorunlara neden olduğunu (örneğin kanser oranlarını arttırdığını) göstermektedir. Normalde telomeraz üretemeyen hücrelerin her birine, tam da doğru miktarda telomeraz sağlamak hiç de kolay bir iş değildir. Bunlar göz önünde alındığında telomer kısalmasının net bir tedavisini bulmak için daha çok üzerinde çalışılması ve gen tedavisi yöntemlerinin de daha fazla gelişmesi gerekmektedir. (Evrim Ağacı)









